Giải Hoá học tập 9 bài 2: một số oxit quan trọng là tài liệu vô cùng có ích giúp những em học viên lớp 9 gồm thêm nhiều gợi nhắc tham khảo nhằm giải các thắc mắc trang 9, 11 chương 1 được nhanh lẹ và dễ dãi hơn.
Bạn đang xem: Soạn bài hóa học 9
Giải Hóa 9 bài 2 được trình diễn rõ ràng, cẩn thận, dễ dàng hiểu nhằm mục đích giúp học sinh gấp rút biết biện pháp làm bài, bên cạnh đó là tứ liệu hữu ích giúp giáo viên dễ dãi trong việc hướng dẫn học sinh học tập. Vậy sau đây là nội dung cụ thể Giải bài tập Hóa 9 bài 2 một số trong những oxit quan liêu trọng, mời các bạn cùng sở hữu tại đây.
Giải Hoá 9 bài bác 2: một trong những oxit quan trọng
Lý thuyết Hóa 9 bài 2: một số trong những oxit quan tiền trọngGiải bài bác tập Hóa 9 bài xích 2 trang 9Giải bài bác tập Hóa 9 bài 2 trang 11
Lý thuyết Hóa 9 bài xích 2: một số trong những oxit quan liêu trọng
I. Can xi oxit
- công thức hóa học tập là Ca
O, tên thông thường là vôi sống, là hóa học rắn, màu trắng.
1. Tính chất hóa học
Ca
O có không thiếu tính hóa chất của oxit bazơ.
a) chức năng với nước: Ca
O (r) + H2O (l) → Ca(OH)2 (r)
Phản ứng của Ca
O với nước gọi là phản bội ứng tôi vôi, phản ứng này tỏa các nhiệt.
Chất Ca(OH)2 chế tạo ra thành hotline là vôi tôi, là chất rắn màu trắng, ít tan trong nước, phần tan tạo thành hỗn hợp bazơ nói một cách khác là nước vôi trong.
Ca
O gồm tính hút ẩm mạnh yêu cầu được dùng để làm khô những chất.
b) công dụng với axit chế tạo ra thành muối với nước.
Ví dụ:
Ca
O + 2HCl → Ca
Cl2 + H2O
Nhờ tính chất này, Ca
O được dùng để khử chua đất trồng trọt, xử lý nước thải của không ít nhà vật dụng hóa chất, …
c) công dụng với oxit axit chế tạo thành muối.
Vì vậy Ca
O sẽ giảm unique nếu lưu giữ lâu ngày trong tự nhiên.
2. Ứng dụng của can xi oxit
Ca
O bao gồm ứng dụng hầu hết sau đây:
- phần nhiều canxi oxit được sử dụng trong công nghiệp luyện kim cùng làm vật liệu cho công nghiệp hóa học.
- ngoại trừ ra, canxi oxit còn được dùng để làm khử chua khu đất trồng trọt, up load nước thải công nghiệp, tiếp giáp trùng, diệt nấm, khử độc môi trường,…
- can xi oxit tất cả tính hút độ ẩm mạnh đề xuất được dùng để triển khai khô các chất.
3. Sản xuất canxi oxit vào công nghiệp
Nguyên liệu nhằm sản xuất canxi oxit là đá vôi (chứa Ca
CO3). Hóa học đốt là than đá, củi, dầu, khí tự nhiên,…
Các bội nghịch ứng hóa học xảy ra khi nung đá vôi
II. Lưu huỳnh đioxit
- phương pháp hóa học tập là SO2, tên gọi khác là khí sunfurơ.
1. Tính chất vật lí
Lưu huỳnh đioxit là hóa học khí ko màu, mùi hương hắc, độc (gây ho, viêm mặt đường hô hấp…), nặng hơn không khí.
2. Tính chất hóa học
Lưu huỳnh đioxit có vừa đủ tính chất hóa học của oxit axit.
a) tác dụng với nước chế tạo ra thành dung dịch axit:
SO2 + H2O → H2SO3 (axit sunfurơ)
SO2 là hóa học gây ô nhiễm và độc hại không khí, là một trong trong các lý do gây ra mưa axit.
b) chức năng với dung dịch bazơ sản xuất thành muối cùng nước:
Ví dụ:
SO2 + Ca(OH)2 → Ca
SO3 ↓ + H2O
Khi SO2 dư sẽ tiếp tục có phản nghịch ứng sau:
SO2 (dư) + H2O + Ca
SO3 ↓ → Ca(HSO3)2
Như vậy khi đến SO2 công dụng với dung dịch bazơ phụ thuộc vào tỉ lệ về số mol mà sản phẩm thu được là muối bột trung hòa, muối axit hoặc các thành phần hỗn hợp cả hai muối.
3. Ứng dụng của lưu hoàng đioxit
- nhiều phần SO2 dùng để làm sản xuất axit sunfuric H2SO4.
- sử dụng làm chất tẩy white bột gỗ trong sản xuất giấy, đường,…
- cần sử dụng làm hóa học diệt nấm mèo mốc,…
4. Điều chế lưu hoàng đioxit
a) Trong phòng thí nghiệm: mang đến muối sunfit tác dụng với axit bạo gan như HCl, H2SO4,…
Thí dụ:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Khí SO2 được thu bằng phương thức đẩy ko khí.
b) vào công nghiệp: Đốt lưu hoàng hoặc quặng pirit sắt Fe
S2 trong ko khí:
S + O2 → SO2
4Fe
S2 + 11O2 → 2Fe2O3 + 8SO2
Giải bài xích tập Hóa 9 bài xích 2 trang 9
Câu 1
Bằng phương pháp hóa học nào rất có thể nhận biết được từng chất trong những dãy hóa học sau:
a) Hai chất rắn màu trắng là Ca
O với Na2O.
b) Hai hóa học khí không màu là CO2 với O2
Viết đa số phương trình bội nghịch ứng hóa học.
Gợi ý đáp án
a) lấy một không nhiều mỗi hóa học cho tính năng với nước, kế tiếp đem lọc, nước lọc của những dung chất dịch này được thử bằng khí CO2 hoặc hỗn hợp Na2CO3. Nếu có kết tủa white thì chất ban sơ là Ca
O, nếu không tồn tại kết tủa thì chất thuở đầu là Na2O. Phương trình phản nghịch ứng :
Ca
O + H2O → Ca(OH)2
Ca(OH)2 + CO2 → Ca
CO3 ↓ + H2O
Hoặc Ca(OH)2 + Na2CO3 → Ca
CO3 ↓ + 2Na
OH
Na2O + H2O → 2Na
OH
2Na
OH + CO2 → Na2CO3 + H2O.
b) Sục hai chất khí ko màu vào hai ống nghiệm cất nước vôi Ca(OH)2 trong. Ống nghiệm làm sao bị vẩn đục, thì khí lúc đầu là CO2, khí sót lại là O2.
PTPỨ: Ca(OH)2 + CO2 → Ca
CO3↓ + H2O
Câu 2
Hãy nhận ra từng cặp chất trong những nhóm chất sau bằng phương pháp hóa học:
a) Ca
O, Ca
CO3
b) Ca
O, Mg
O
Viết các phương trình phản bội ứng hóa học.
Gợi ý đáp án
Nhận biết từng chất trong những nhóm hóa học sau:
a) Ca
O cùng Ca
CO3.
Lẫy mẫu thử từng hóa học cho từng chủng loại thử vào nước khuấy đều.
Mẫu nào tính năng mạnh với H2O là Ca
O.
Mẫu sót lại không tan trong nước là Ca
CO3.
PTPỨ: Ca
O + H2O → Ca(OH)2
b) Ca
O cùng Mg
O.
Lấy mẫu mã thử từng chất và cho chức năng với H2O khuấy đều.
Mẫu nào bội phản ứng khỏe khoắn với H2O là Ca
O.
Mẫu sót lại không tính năng với H2O là Mg
O.
PTPỨ: Ca
O + H2O → Ca(OH)2
Câu 3
200ml dung dịch HCl bao gồm nồng độ 3,5mol/lit hòa tan vừa đủ 20g tất cả hổn hợp Cu
O và Fe2O3.
a) Viết những phương trình phản nghịch ứng hóa học.
b) Tính cân nặng của từng oxit bazơ có trong tất cả hổn hợp ban đầu.
Gợi ý đáp án
VHCl = 200ml = 0,2 lít
n
HCl = 3,5 x 0,2 = 0,7 mol.
Gọi x, y là số mol của Cu
O và Fe2O3.
VHCl = 200ml = 0,02 lít
n
HCl = 3,5 x 0,02 = 0,7 mol.
Gọi x, y là số mol của Cu
O cùng Fe2O3
a)
Cu
O + 2HCl → Cu
Cl2 + H2O
x 2x
Fe2O3 + 6HCl → 2Fe
Cl3 + 3 H2O
y 6y
b)
⇒ n
HCl = 2x + 6y = 0,7 mol (∗)
mhỗn đúng theo = m
Cu
O + m
Fe2O3 = 80x + 160y = 20g
⇒ x + 2y = 0,25 ⇒ x = 0,25 – 2y (∗∗)
=> x = 0,25 - 2.0,1 = 0,05 mol
⇒ m
Cu
O = 0,05 x 80 = 4g
m
Fe2O3 = 0,1 x 160 = 16g
Câu 4
Biết 2,24 lit khí CO2 (đktc) công dụng vừa đủ với 200ml hỗn hợp Ba(OH)2 thành phầm sinh ra là Ba
CO3 với H2O.
a) Viết phương trình bội nghịch ứng.
b) Tính mật độ mol của hỗn hợp Ba(OH)2 vẫn dùng.
c) Tính cân nặng chất kết tủa thu được.
Gợi ý đáp án
n
CO2 = V / 22,4 = 2,24 / 22,4 =0,1 mol.
CO2 + Ba(OH)2 → Ba
CO3 ↓ + H2O
n
Ba(OH)2 = n
CO2 = 0,1 mol,
VBa(OH)2 = 200ml = 0,2 lít
⇒ cm Ba(OH)2 = n / V = 0,1 / 0,2 = 0,5 M.
c)n
Ba
CO3 = n
CO2 = 0,1 mol.
=> m
Ba
CO3 = 0,1 x 197 = 19,7 g.
Giải bài xích tập Hóa 9 bài bác 2 trang 11
Câu 1
Viết phương trình hóa học mang lại mỗi thay đổi sau:
Gợi ý đáp án
(1) S + O2

(2) SO2 + Ca
O → Ca
SO3
Hay SO2 + Ca(OH)2(dd) → Ca
SO3↓ + H2O
(3) SO2 + H2O ⇆ H2SO3
(4) H2SO3 + 2Na
OH → Na2SO3 + 2H2O
Hoặc H2SO3 + Na2O → Na2SO3 + H2O
(5) Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
Không đề xuất dùng phản nghịch ứng:
Na2SO3 + 2HCl → 2Na
Cl + SO2 ↑ + H2O vày HCl dễ bay hơi phải khí SO2 thu được sẽ không còn tinh khiết.
(6) SO2 + 2Na
OH → Na2SO3 + H2O
Hoặc SO2 + Na2O → Na2SO3
Câu 2
Hãy nhận biết từng chất trong mỗi nhóm hóa học sau bằng phương pháp hóa học:
a) Hai chất rắn màu trắng là Ca
O và P2O5.
b) Hai chất khí ko màu là SO2 và O2.
Viết các phương trình hóa học.
Gợi ý đáp án
Nhận biết những chất sau:
a) Ca
O và P2O5
Lẫy chủng loại từng hóa học và bỏ vô nước thu được 2 dung dịch Ca(OH)2 với H3PO4
Dùng quỳ tím đến vào những mẫu này.
Mẫu nào làm cho quỳ tím hóa xanh là Ca(OH)2 → hóa học rắn ban sơ là: Ca
O.
Mẫu nào làm quỳ tím hóa đỏ là H3PO4 ⇒ chất rắn ban đầu là P2O5
PTHH: Ca
O + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
b) SO2 và O2.
Lấy chủng loại thử từng khí.
Lấy quỳ tím ẩm cho vào từng mẫu thử. Chủng loại nào có tác dụng quỳ tím hóa đỏ là SO2, sót lại là O2.
PTHH: SO2 + H2O → H2SO3
Câu 3
Có số đông khí ẩm (khí gồm lẫn tương đối nước): cacbon đioxit, hiđro, oxi, lưu hoàng đioxit. Khí nào hoàn toàn có thể làm khô bởi canxi oxit? Giải thích.
Gợi ý đáp án
Điều khiếu nại chất hoàn toàn có thể làm thô được hầu như chất khác:
+ cần hút độ ẩm được.
+ Không công dụng với chất được thiết kế khô.
Ta thấy Ca
O tất cả tính hút ẩm (hơi nước) sinh sản thành Ca(OH)2, đồng thời là một trong những oxit bazơ (tác dụng cùng với oxit axit). Vì thế Ca
O chỉ dùng làm khô những khí ẩm là hiđro ẩm, oxi ẩm.
Câu 4
Có đầy đủ chất khí sau: CO2, H2, O2, SO2, N2. Hãy cho thấy thêm chất nào có tính chất sau:
a) Nặng rộng không khí.
b) nhẹ hơn khống khí.
c) Cháy được trong không khí.
Xem thêm: Máy Bào Cuốn Streng - Máy Bào Cuốn 6 Tấc Tải Nặng Dao Xoắn Wm
d) chức năng với nước tạo thành thành hỗn hợp axit.
e) làm cho đục nước vôi trong.
g) Đổi màu sắc giấy quỳ tím ẩm thành đỏ.
Gợi ý đáp án
a) phần lớn khí nặng rộng không khí: CO2, O2, SO2.
Vì Mkk = 29 g/mol.
MCO2 = 12 + 16.2 = 44 g/mol

⇒ CO2 nặng hơn kk
Tương tự: MO2 = 16.2 = 32 g/mol , MSO2 = 32 + 16.2 = 64g/mol
b) các khí khối lượng nhẹ hơn không khí: H2, N2.
Mkk = 29 g/mol.
MH2 = 1.2 = 2 g/mol

Tương tự: MN2 = 14.2 = 28g/mol
c) hầu như khí cháy được trong ko khí: H2.
2H2 + O2 → 2H2O
d) phần nhiều khí tác dụng với nước chế tác thành dung dịch axit: CO2, SO2.
PTHH: CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
e) hầu hết khí làm đục nước vôi trong: CO2, SO2.
Ca(OH)2 + CO2 → Ca
CO3 ↓ + H2O
Ca(OH)2 + SO2 → Ca
SO3 ↓ + H2O
g) phần nhiều khí làm thay đổi màu quỳ tím ẩm thành đỏ: CO2, SO2.
Quỳ tím độ ẩm ⇒ xẩy ra phản ứng với nước tạo axit làm quỳ tím gửi đỏ
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
Câu 5
Khí lưu huỳnh đioxit được chế tác thành từ cặp chất nào sau đây:
a) K2SO3 với H2SO4.
b) K2SO4 với HCl.
c) Na2SO3 với Na
OH.
d) Na2SO4 cùng Cu
Cl2.
e) Na2SO3 cùng Na
Cl.
Gợi ý đáp án
Khí SO2 được sinh sản thành tự cặp chất: a
Phương trình hóa học minh họa:
K2SO3 + H2SO4 → K2SO4 + SO2 ↑ + H2O.
Câu 6
Dẫn 112ml khí SO2 (đktc) đi qua 700ml hỗn hợp Ca(OH)2 bao gồm nồng độ 0,01 M, sản phẩm là muối canxi sunfit.
a) Viết phương trình làm phản ứng hóa học.
b) Tính khối lượng các chất sau phản ứng.
Gợi ý đáp án
a) SO2+ Ca(OH)2→ Ca
SO3↓ + H2O
1 mol 1 mol 1 mol 1 mol
b) VSO2= 112ml = 0,112 l; VCa(OH)2= 700ml = 0,7 l
n
SO2 = V / 22,4 = 0,112 / 22,4 = 0,005 (mol)
n
Ca(OH)2 = cm . V = 0,01. 0,7 = 0,007 (mol)
SO2 không còn Ca(OH)2 dư
Theo pt n
Ca(OH)2 = n
SO2 = 0,005 mol
⇒ n
Ca(OH)2 dư = 0,007 – 0,005 = 0,002 (mol)
m
Ca(OH)2 dư = n . M = 0,002 × 74 = 0,148 (g)
n Ca
SO3 = n
SO2 = 0,005 mol → m
Ca
SO3 = n. M = 0,005 × 120 = 0,6 (g).
Trắc nghiệm hóa học 9 bài xích 2
Câu 1: Ca
O nhằm lâu trong bầu không khí bị giảm unique là vì:
A. Ca
O tính năng với O2
B. Ca
O tác dụng với CO2
C. Ca
O dụng cùng với nước
D. Cả B cùng C
Câu 2: Ca
O dùng làm chất khử chua đất trồng là ứng dụng đặc điểm hóa học tập gì của Ca
O?
A. Chức năng với axit
B. Tính năng với bazơ
C. Tính năng với oxit axit
D. Tính năng với muối
Câu 3: áp dụng chất thử nào để sáng tỏ hai chất rắn color trắng: Ca
O với P2O5
A. Hỗn hợp phenolphtalein
B. Giấy quỳ ẩm
C. Hỗn hợp axit clohiđric
D. A, B cùng C hầu hết đúng
Câu 4: Oxit được sử dụng làm chất hút độ ẩm (chất làm khô) vào phòng nghiên cứu là:
A. Cu
O
B. Zn
O
C. Pb
O
D. Ca
O
Câu 5: Dẫn tất cả hổn hợp khí gồm CO2, CO, SO2lội qua dung dịch nước vôi trong (dư), khí bay ra là:
A. CO
B. CO2
C. SO2
D. CO2 với SO2
Câu 6: Để nhận biết 3 khí ko màu: SO2, O2, H2đựng vào 3 lọ mất nhãn ta dùng
- Chọn bài xích -Bài 1: đặc điểm hóa học tập của oxit. Khái quát về sự phân các loại oxitBài 2: một trong những oxit quan lại trọng
Bài 3: đặc thù hóa học của axit
Bài 4: một trong những axit quan trọng
Bài 5: Luyện tập: đặc điểm hóa học của oxit cùng axit
Bài 6: Thực hành: đặc điểm hóa học của oxit cùng axit
Bài 7: đặc thù hóa học tập của bazơ
Bài 8: một số trong những bazơ quan tiền trọng
Bài 9: đặc thù hóa học tập của muối
Bài 10: một số muối quan trọng
Bài 11: Phân bón hóa học
Bài 12: mối quan hệ giữa những loại hợp chất vô cơ
Bài 13: rèn luyện chương 1: những loại hợp hóa học vô cơ
Bài 14: Thực hành: đặc điểm hóa học tập của bazơ và muối
Mục lục
Xem toàn bộ tài liệu Lớp 9: tại đâyXem toàn thể tài liệu Lớp 9
: tại đâyGiải bài Tập chất hóa học 9 – bài xích 2: một vài oxit đặc trưng giúp HS giải bài tập, cung ứng cho những em một hệ thống kiến thức và sinh ra thói quen học tập thao tác làm việc khoa học, làm căn nguyên cho việc phát triển năng lượng nhận thức, năng lực hành động:
Bài 1: Bằng phương pháp hóa học nào hoàn toàn có thể nhận biết được từng chất trong những dãy chất sau:a) Hai chất rắn white color là Ca
O và Na2O.
b) Hai chất khí không màu là CO2 cùng O2
Viết hồ hết phương trình bội nghịch ứng hóa học.
Lời giải:
a) đem một ít mỗi hóa học cho chức năng với nước, tiếp nối đem lọc, nước lọc của các dung chất dịch này được thử bằng khí CO2 hoặc hỗn hợp Na2CO3. Nếu tất cả kết tủa trắng thì chất ban đầu là Ca
O, nếu không tồn tại kết tủa thì chất thuở đầu là Na2O. Phương trình phản ứng :
Ca
O + H2O → Ca(OH)2
Ca(OH)2 + CO2 → Ca
CO3 ↓ + H2O
Hoặc Ca(OH)2 + Na2CO3 → Ca
CO3 ↓ + 2Na
OH
Na2O + H2O → 2Na
OH
2Na
OH + CO2 → Na2CO3 + H2O.
b) Sục hai hóa học khí ko màu vào hai ống nghiệm chứa nước vôi Ca(OH)2 trong. Ống nghiệm làm sao bị vẩn đục, thì khí ban sơ là CO2, khí còn lại là O2.
PTPỨ: Ca(OH)2 + CO2 → Ca
CO3↓ + H2O
A. Can xi oxit
Bài 2: Hãy phân biệt từng cặp chất trong mỗi nhóm chất sau bằng cách thức hóa học:a) Ca
O, Ca
CO3
b) Ca
O, Mg
O
Viết các phương trình phản nghịch ứng hóa học.
Lời giải:
Nhận biết từng chất trong những nhóm chất sau:
a) Ca
O cùng Ca
CO3.
Lẫy mẫu thử từng hóa học cho từng mẫu mã thử vào nước khuấy đều.
Mẫu nào tính năng mạnh với H2O là Ca
O.
Mẫu còn lại không rã trong nước là Ca
CO3.
PTPỨ: Ca
O + H2O → Ca(OH)2
b) Ca
O với Mg
O.
Lấy mẫu thử từng hóa học và cho chức năng với H2O khuấy đều.
Mẫu nào phản nghịch ứng táo bạo với H2O là Ca
O.
Mẫu còn sót lại không tác dụng với H2O là Mg
O.
PTPỨ: Ca
O + H2O → Ca(OH)2
A. Can xi oxit
Bài 3: 200ml hỗn hợp HCl gồm nồng độ 3,5mol/lit hòa tan trọn vẹn 20g các thành phần hỗn hợp CuO với Fe2O3.
a) Viết các phương trình bội nghịch ứng hóa học.
b) Tính khối lượng của mỗi oxit bazơ có trong các thành phần hỗn hợp ban đầu.
Lời giải:
VHCl = 200ml = 0,02 lít
n
HCl = 3,5 x 0,02 = 0,7 mol.
Gọi x, y là số mol của Cu
O và Fe2O3.
a) Phương trình làm phản ứng chất hóa học :
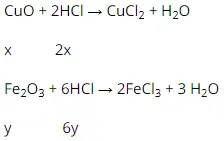
b) từ bỏ phương trình bội phản ứng trên ta có:
n
HCl (1) = 2.n
Cu
O = 2x mol
n
HCl (2) = 6.n
Fe2O3 = 6y mol
⇒ n
HCl = 2x + 6y = 0,7 mol (∗)
m
Cu
O = (64 + 16).x = 80x g; m
Fe2O3 = (56.2 + 16.3).y = 160y g
Theo bài: mhỗn đúng theo = m
Cu
O + m
Fe2O3 = 80x + 160y = 20g
⇒ x + 2y = 0,25 ⇒ x = 0,25 – 2y (∗∗)
Thay x vào (∗) ta được: 2(0,25 – 2y) + 6y = 0,7
⇒ 0,5 – 4y + 6y = 0,7 ⇒ 2y = 0,2 ⇒ y = 0,1 mol
Thay y vào (∗∗) ta được: x = 0,25 – 2.0,1 = 0,05 mol
⇒ m
Cu
O = 0,05 x 80 = 4g
m
Fe2O3 = 0,1 x 160 = 16g
(Lưu ý: lịch sự kì 2 chúng ta mới học tập về Hệ phương trình yêu cầu bài này không giải theo cách mang đến hệ phương trình.)
A. Canxi oxit
Bài 4: Biết 2,24 lit khí CO2 (đktc) tính năng vừa đủ với 200ml hỗn hợp Ba(OH)2 thành phầm sinh ra là BaCO3 và H2O.
a) Viết phương trình phản ứng.
b) Tính nồng độ mol của hỗn hợp Ba(OH)2 vẫn dùng.
c) Tính cân nặng chất kết tủa thu được.
Lời giải:
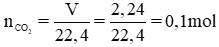
a) Phương trình bội nghịch ứng hóa học:
CO2 + Ba(OH)2 → Ba
CO3 ↓ + H2O
b) dựa vào phương trình làm phản ứng bên trên ta dìm thấy:
n
Ba(OH)2 = n
CO2 = 0,1 mol, VBa(OH)2 = 200ml = 0,2 lít
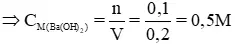
c) nhờ vào phương trình bội phản ứng bên trên ta có:
n
Ba
CO3 = n
CO2 = 0,1 mol.
⇒ m
Ba
CO3 = 0,1 x 197 = 19,7 g.
A. Can xi oxit
Bài 1: Viết phương trình hóa học cho mỗi biến hóa sau: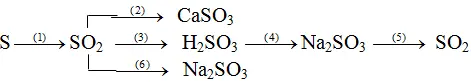
Lời giải:
(1) S + O2 → SO2
(2) SO2 + Ca
O → Ca
SO3
Hay SO2 + Ca(OH)2(dd) → Ca
SO3 + H2O
(3) SO2 + H2O → H2SO3
(4) H2SO3 + 2Na
OH → Na2SO3 + 2H2O
Hoặc H2SO3 + Na2O → Na2SO3 + H2O
(5) Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
Không phải dùng phản nghịch ứng:
Na2SO3 + 2HCl → 2Na
Cl + SO2 ↑ + H2O vày HCl dễ bay hơi yêu cầu khí SO2 thu được sẽ không tinh khiết.
(6) SO2 + 2Na
OH → Na2SO3 + H2O
Hoặc SO2 + Na2O → Na2SO3
B. Diêm sinh đioxit
Bài 2: Hãy nhận biết từng cặp chất trong mỗi nhóm hóa học sau bằng phương pháp hóa học:a) Ca
O, Ca
CO3
b) Ca
O, Mg
O
Viết những phương trình làm phản ứng hóa học.
Lời giải:
Nhận biết từng chất trong những nhóm chất sau:
a) Ca
O và Ca
CO3.
Lẫy mẫu thử từng chất cho từng chủng loại thử vào nước khuấy đều.
Mẫu nào chức năng mạnh cùng với H2O là Ca
O.
Mẫu còn sót lại không tan trong nước là Ca
CO3.
PTPỨ: Ca
O + H2O → Ca(OH)2
b) Ca
O và Mg
O.
Lấy mẫu mã thử từng hóa học và cho tính năng với H2O khuấy đều.
Mẫu nào phản nghịch ứng mạnh khỏe với H2O là Ca
O.
Mẫu sót lại không chức năng với H2O là Mg
O.
PTPỨ: Ca
O + H2O → Ca(OH)2
A. Canxi oxit
Bài 3: có những khí ẩm (khí tất cả lẫn tương đối nước): cacbon đioxit, hiđro, diêm sinh đioxit. Khí nào có thể làm khô bằng canxi oxit? Giải thích.Lời giải:
+ cần hút độ ẩm được.
+ Không tính năng với chất được gia công khô.
Ca
O có tình hút ẩm (hơi nước) sinh sản thành Ca(OH)2, đồng thời là một trong oxit bazơ (tác dụng với oxit axit). Vì vậy Ca
O chỉ dùng làm khô những khí ẩm là hiđro ẩm, oxi ẩm.
B. Lưu huỳnh đioxit
Bài 4: bao hàm chất khí sau: CO2, H2, O2, SO2, N2. Hãy cho biết thêm chất làm sao có đặc thù sau:a) Nặng rộng không khí.
b) khối lượng nhẹ hơn khống khí.
c) Cháy được trong ko khí.
d) tác dụng với nước chế tạo ra thành hỗn hợp axit.
e) có tác dụng đục nước vôi trong.
g) Đổi màu sắc giấy quỳ tím ẩm thành đỏ.
Lời giải:
a) rất nhiều khí nặng rộng không khí: CO2, O2, SO2.
Vì Mkk = 29 g/mol.
MCO2 = 12 + 16.2 = 44 g/mol
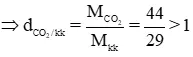
⇒ CO2 nặng hơn kk
Tương tự: MO2 = 16.2 = 32 g/mol , MSO2 = 32 + 16.2 = 64g/mol
b) đầy đủ khí khối lượng nhẹ hơn không khí: H2, N2.
Mkk = 29 g/mol.
MH2 = 1.2 = 2 g/mol
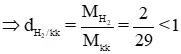
⇒ H2 nhẹ nhàng hơn kk
Tương tự: MN2 = 14.2 = 28g/mol
c) phần đa khí cháy được trong không khí: H2.
2H2 + O2 → 2H2O
d) những khí tính năng với nước tạo ra thành hỗn hợp axit: CO2, SO2.
PTHH: CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
e) hầu như khí làm cho đục nước vôi trong: CO2, SO2.
Ca(OH)2 + CO2 → Ca
CO3 ↓ + H2O
Ca(OH)2 + SO2 → Ca
SO3 ↓ + H2O
g) hồ hết khí làm đổi màu quỳ tím ẩm thành đỏ: CO2, SO2.
Quỳ tím ẩm ⇒ xẩy ra phản ứng cùng với nước chế tác axit làm cho quỳ tím gửi đỏ
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
B. Diêm sinh đioxit
Bài 5: Khí lưu hoàng đioxit được tạo thành từ bỏ cặp hóa học nào sau đây:a) K2SO3 và H2SO4.
b) K2SO4 với HCl.
c) Na2SO3 và Na
OH.
d) Na2SO4 với Cu
Cl2.
e) Na2SO3 với Na
Cl.
Lời giải:
Khí SO2 được tạo thành thành trường đoản cú cặp chất:
K2SO3 + H2SO4 → K2SO4 + SO2 ↑ + H2O.
B. Lưu huỳnh đioxit
Bài 6: Dẫn 112ml khí SO2 (đktc) trải qua 700ml dung dịch Ca(OH)2 gồm nồng độ 0,01 M, sản phẩm là muối canxi sunfit.a) Viết phương trình bội phản ứng hóa học.








